|
Resumen:
|
[ES] El mieloma múltiple (MM) es una neoplasia hematológica caracterizada por una expansión
clonal de las células plasmáticas (CPs). Los cultivos 2D convencionales se ha visto que no
consiguen reproducir el desarrollo ...[+]
[ES] El mieloma múltiple (MM) es una neoplasia hematológica caracterizada por una expansión
clonal de las células plasmáticas (CPs). Los cultivos 2D convencionales se ha visto que no
consiguen reproducir el desarrollo de la enfermedad y actualmente se están llevando a cabo
diseños y desarrollos de modelos de cultivo 3D que permitan reproducir “in vitro” el
comportamiento de las CPs y su resistencia a fármacos mediada por el microambiente medular.
La progresión a una medicina personalizada sería un hecho realista con un modelo 3D que
permita el cultivo de células ex vivo de pacientes.
El objetivo principal del siguiente trabajo ha consistido en desarrollar un modelo de cultivo 3D
basado en microgel, que mediante el recubrimiento de las microesferas con distintas
biomoléculas procedentes de la médula ósea, como son el colágeno tipo I y el ácido hialurónico
(HA), permita evaluar la influencia de estas biomoléculas en la proliferación celular de las CPs.
El microgel ha sido producido mediante un sistema de microfluídica, permitiendo obtener
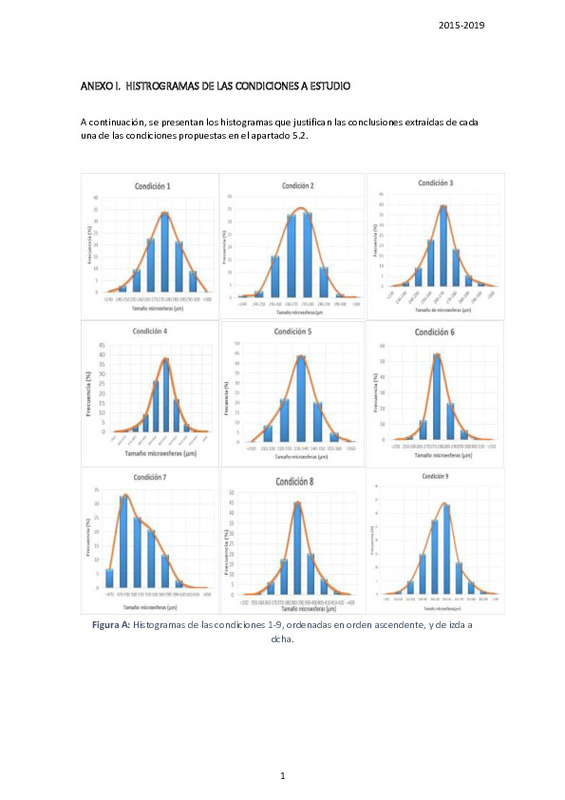
microesferas de alginato de un tamaño comprendido 170-190 µm, y con un alto rendimiento.
Las microesferas fueron funcionalizadas con Colágeno Tipo I y ácido hialurónico por el método
Layer-by-Layer. La presencia de Colágeno y HA en las microesferas se confirmó de forma
cualitativa por FTIR, mientras que, por medio de BCA se evaluó de forma cuantitativa la
presencia de Colágeno Tipo I.
Posteriormente, las células de la línea RPMI 8226 se cultivaron en suspensión agitada y entre las
microesferas del microgel. La proliferación celular se evaluó mediante el ensayo PicoGreen. Se
observaron diferencias significativas de proliferación dependiendo de las condiciones de cultivo:
células en suspensión agitada, microgel sin funcionalizar y microgel funcionalizados con HA, Col
y ambas biomoléculas.
En definitiva, el desarrollo de un cultivo 3D basado en microgel presenta diferencias
significativas en cuanto a la proliferación de las CPs con respecto a células en suspensión,
observándose mayores diferencias en los microgeles recubiertos con HA. Esto corroboraría la
importancia de desarrollar entornos 3D que permitan reproducir “in vitro” el microambiente
medular.
[-]
[EN] Multiple myeloma is a hemathological neoplasm characterised by a clonal expansion of
plasmatic cells (PC). Conventional 2D cultures aren’t able to reproduce the development of the
disease, so, 3D culture models are ...[+]
[EN] Multiple myeloma is a hemathological neoplasm characterised by a clonal expansion of
plasmatic cells (PC). Conventional 2D cultures aren’t able to reproduce the development of the
disease, so, 3D culture models are currently being developed in order to allow the “in vivo”
reproduction of plasmatic cells behaviour and their resistance to drugs mediated by the bone
marrow (BM) microenvironment. Progression to a personalized medicine would be a realistic
fact with this 3D models for cell ex vivo culture.
The main objective of this work is the development of a microgel based 3D cell culture model,
that due to their coating with different biomolecules originated in the bone marrow, like the
type I collagen and hyaluronic acid, allows to evaluate the influence of this biomolecules in the
proliferation of PC.
The microgel has been produced in a microfluidic system, allowing us to obtain alginate
microspheres of an average size of between 170-190 µm and optimum production throughput.
Microspheres were functionalized with type I collagen and hyaluronic acid by a layer-by-layer
method. The material characterization of the different coatings applied was made by the means
of Fourier transformed infrared spectroscopy, while the type I collagen coating was essayed
through bicinconinic acid essay (BCA).
RPMI 8226 cell line has been cultivated between the microgel microspheres by maintaining the
suspension in an orbital shaker. Cell proliferation was evaluated through PicoGreen assay. There
were significant differences in proliferation depending on culture conditions: cells in suspension,
cells with microgel and cells with different functionalized microgels.
Definitely, the development of a microgel based 3D culture presents significant differences
regarding the proliferation of the PC when compared to cells in suspension, observing this way
major differences in microgels coated with hyaluronic acid. This fact would bear out the
importance of developing 3D models that allow "in vitro” reproduction of the BM
microenvironment.
[-]
|