|
Resumen:
|
[ES] El folato es un cofactor esencial que actúa como aceptor/dador de unidades de un carbono (1C). La serina es el principal donante de unidades de 1C para la biosíntesis de nucleótidos, así como de glicina para la síntesis ...[+]
[ES] El folato es un cofactor esencial que actúa como aceptor/dador de unidades de un carbono (1C). La serina es el principal donante de unidades de 1C para la biosíntesis de nucleótidos, así como de glicina para la síntesis de glutatión, esencial en el control del estrés oxidativo. De forma complementaria, el ciclo de la metionina/transmetilación, a través de la síntesis de S-adenosil-metionina, es la principal fuente de grupos metilo en la metilación de DNA, RNA y proteínas, con lo que juega un papel esencial en la regulación de la expresión génica, así como en la actividad de múltiples proteínas. El metabolismo del cofactor folato, cuya disponibilidad y estado químico determinan el correcto funcionamiento estas rutas, frecuentemente alteradas en cáncer debido tanto al metabolismo intrínseco de las células presentes, como a la disponibilidad de nutrientes y cofactores. La presencia de concentraciones no fisiológicas de estos metabolitos en los medios comerciales supone una limitación a la información que se puede obtener in vitro.
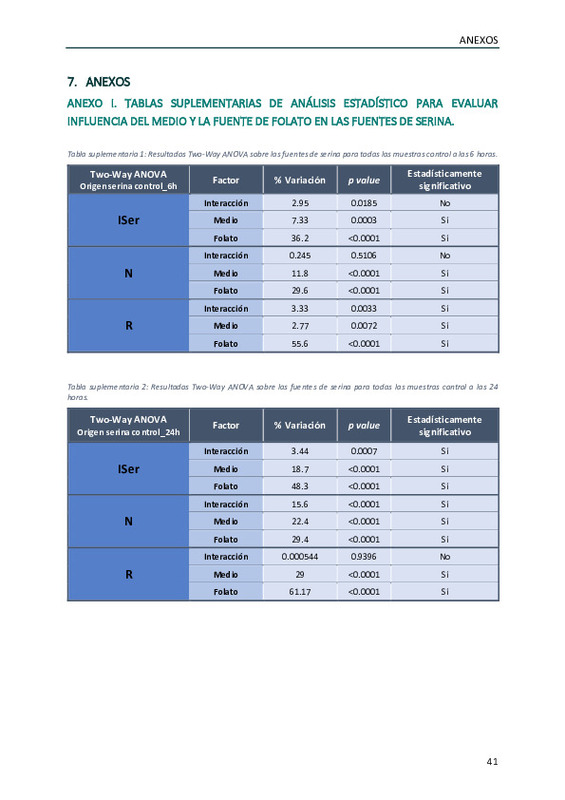
Nuestro objetivo es estudiar la influencia de las condiciones de cultivo en la proliferación, el metabolismo de serina-folato-1C y la sensibilidad a inhibidores de dicha ruta, SHIN2 (inhibidor de la enzima serina-hidroximetiltransferasa) y metotrexato (inhibidor de la dihidrofolato-reductasa), en linfocitos T CD8+ efectores de ratón.
Para ello comparamos el medio estándar RPMI con el medio HPLM, que contiene concentraciones fisiológicas de aminoácidos y glucosa, y en ambos casos empleando concentraciones normales o fisiológicas de folato (1 mg/L de folato vs 0.1 mg/mL de 5-MeTHF). El estudio del metabolismo se realiza mediante el empleo de trazadores isotópicos estables (U-13C-glucosa, U-13C-serina, U-13C-glicina, 2H1-glucosa) y su análisis mediante metabolómica basada en cromatografía líquida acoplada a espectrometría de masas de alta resolución.
En comparación con condiciones de cultivo estándar, tanto el medio HPLM como el uso de concentraciones fisiológicas de folatos limitan la proliferación de los linfocitos. El efecto de los folatos se debe a la limitación de las unidades de 1C disponibles mientras que la disponibilidad de serina y glutamina juegan un papel clave en HPLM. En comparación con RPMI, en el medio HPLM se observa una mayor síntesis de novo de serina a partir de glucosa, una relevancia mayor de la importación en las fuentes de glicina y una menor contribución relativa de la ruta de las pentosas fosfato a la síntesis de NADPH. En ambos medios, el uso de folatos fisiológicos limita la actividad SHMT. En relación con los inhibidores, tanto metotrexato como SHIN2 afectan a la ruta de biosíntesis de purinas. Sin embargo, mientras que el metotrexato no provoca variaciones en el perfil de origen de serina y glicina, SHIN2 sí lo hace. En ambos casos la fuente de folatos afecta a los efectos metabólicos de los inhibidores.
[-]
[EN] Folate is an essential cofactor that acts as an acceptor/donor of one-carbon (1C) units. Serine is the main donor of 1C units for nucleotide biosynthesis, as well as glycine for glutathione synthesis, essential in the ...[+]
[EN] Folate is an essential cofactor that acts as an acceptor/donor of one-carbon (1C) units. Serine is the main donor of 1C units for nucleotide biosynthesis, as well as glycine for glutathione synthesis, essential in the control of oxidative stress. Complementarily, the methionine/trans-methylation cycle, through the synthesis of S-adenosyl-methionine, is the main source of methyl groups in the methylation of DNA, RNA and proteins, thus playing an essential role in the regulation of gene expression, as well as in the activity of multiple proteins. The metabolism of the cofactor folate, whose availability and chemical status determine the correct functioning of these pathways, frequently altered in cancer due to both the intrinsic metabolism of the cells present, as well as the availability of nutrients and cofactors. The presence of non-physiological concentrations of these metabolites in commercial media limits the information that can be obtained in vitro.
Our aim is to study the influence of culture conditions on proliferation, serine-folate-1C metabolism and sensitivity to inhibitors of this pathway, SHIN2 (serine hydroxymethyltransferase inhibitor) and methotrexate (dihydrofolate reductase inhibitor), in mouse effector CD8+ T lymphocytes.
We compared standard RPMI medium with HPLM medium containing physiological concentrations of amino acids and glucose, and in both cases using normal or physiological concentrations of folate (1 mg/L folate vs 0.1 mg/mL 5-MeTHF). Metabolism is studied using stable isotopic tracers (U-13C-glucose, U-13C-serine, U-13C-glycine, 2H1-glucose) and their analysis by metabolomics based on liquid chromatography coupled to high resolution mass spectrometry.
Compared to standard culture conditions, both HPLM medium and the use of physiological folate concentrations limit lymphocyte proliferation. The effect of folates is due to the limitation of available 1C units while the availability of serine and glutamine play a key role in HPLM. Compared to RPMI, HPLM medium shows a higher de novo synthesis of serine from glucose, a higher relevance of import in glycine sources and a lower relative contribution of the pentose phosphate pathway to NADPH synthesis. In both media, the use of physiological folates limits SHMT activity. With regard to inhibitors, both methotrexate and SHIN2 affect the purine biosynthesis pathway. However, while methotrexate does not cause variations in the serine and glycine origin profile, SHIN2 does. In both cases the source of folates affects the metabolic effects of the inhibitors.
[-]
|