|
Resumen:
|
[ES] En las clínicas de reproducción asistida, tanto en el ámbito humano como animal, uno de los pasos fundamentales es la selección del embrión cultivado de mayor calidad para su posterior transferencia al útero de la ...[+]
[ES] En las clínicas de reproducción asistida, tanto en el ámbito humano como animal, uno de los pasos fundamentales es la selección del embrión cultivado de mayor calidad para su posterior transferencia al útero de la futura gestante. La elección se basa en la interpretación de la calidad que el embriólogo considere al visualizar imágenes del embrión; basándose principalmente en que posea una morfología correcta. Es un método demostrado como subjetivo, variable y poco reproducible; por tanto, en este área se está indagando en la búsqueda de alternativas que sean técnicas no invasivas para el embrión y que proporcionen buenos resultados con el nacimiento de individuos sanos. Este es el objetivo del presente trabajo: que a través de la información recogida mediante la segmentación manual y etiquetado de imágenes de embriones en estadio de hatching (etapa posterior al blastocisto donde el embrión eclosiona y sale de la zona pelúcida para implantarse en el endometrio), se ha desarrollado un modelo de inteligencia artificial basado en un enfoque de Machine Learning supervisado capaz de identificar los embriones de mejor calidad según los criterios de clasificación embrionaria de ASEBIR.
La segmentación manual, una herramienta del procesado de imágenes, se ha realizado mediante la delimitación de los componentes más relevantes del blastocisto: células del trofoectodermo, masa celular interna y la zona pelúcida, entre otros; además, las etiquetas seleccionadas estaban referidas a la calidad del embrión fotografiado y a su estadio de desarrollo. Con esta información previa se ha entrenado y evaluado el modelo y finalmente, se ha testeado con un 10% de imágenes nunca vistas por el sistema para comprobar su funcionamiento. De esta forma, la inteligencia artificial ha podido detectar todos los componentes del embrión, reconocer el estadio de desarrollo en el que se encuentra y asignarle una calificación con respecto a su calidad con una sensibilidad de 0,64 , una precisión del 0,75 y un rendimiento reflejado como el área bajo la curva ROC del 0,79.
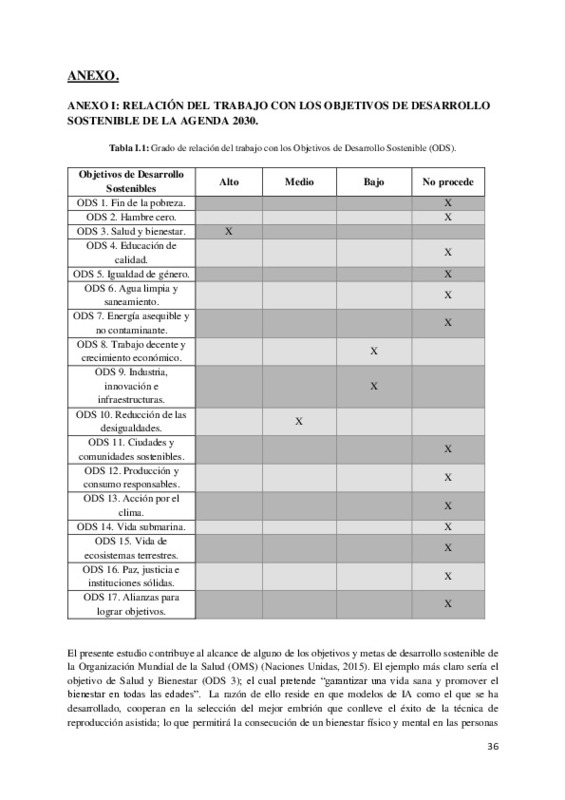
Estos resultados contribuyen a la finalidad de que el modelo pueda ser empleado en los laboratorios y clínicas de medicina reproductiva para la selección del embrión óptimo para transferir al útero de la mujer y reducir la carga subjetiva que supone la elección por parte del embriólogo en cuanto a su criterio. Por lo que este trabajo se relaciona con los siguientes ODS de la Agenda 2030: ODS 3. Salud y Bienestar y ODS 10. Reducción de las Desigualdades.
[-]
[EN] In assisted reproduction clinics, both in the human and animal field, one of the crucial steps is the selection of the highest-quality cultured embryo for subsequent transfer to the uterus of the intended gestational ...[+]
[EN] In assisted reproduction clinics, both in the human and animal field, one of the crucial steps is the selection of the highest-quality cultured embryo for subsequent transfer to the uterus of the intended gestational individual. The choice relies on the interpretation of the quality that the embryologist considers upon visualizing embryo images, mainly based on correct morphology. This method has been shown to be subjective, variable, and poorly reproducible. Therefore, in this field, efforts are being made to explore alternative non-invasive techniques for embryos that yield good results in terms of live births. This is the objective of the present study: where through the collected information from manual segmentation and labeling of hatching stage embryo images (the stage after blastocyst where the embryo hatches and exits the zona pellucida to implant in the endometrium), a supervised Machine Learning- based artificial intelligence model has been developed to identify embryos of better quality according to the ASEBIR embryo classification criteria.
Manual segmentation, an image processing tool, was performed by delineating the most relevant components of the blastocyst: trophectoderm cells, inner cell mass, and the zona pellucida, among others. Additionally, the selected labels referred to the quality of the photographed embryo and its developmental stage. With this prior information, the model was trained and evaluated, and ultimately tested with 10% of images never seen by the system to verify its performance. In this way, artificial intelligence has been able to detect all embryo components, recognize the developmental stage, and assign a quality rating with a sensitivity of 0.64, precision of 0.75, and performance reflected by the area under the ROC curve of 0.79.
These results contribute to the aim that the model can be used in reproductive medicine laboratories and clinics for the selection of the optimal embryo for transfer to the woman's uterus and reduce the subjective burden of the embryologist's choice of criteria. Therefore, this work is related to the following SDGs of the 2030 Agenda: SDG 3. Health and Well-being and SDG 10. Reduction of Inequalities.
[-]
|