|
Resumen:
|
[ES] P2X7 es un receptor inotrópico ligado al canal del calcio implicado en respuestas de daño (trombo-inflamación). Incomprensiblemente, el receptor para ser activado requiere concentraciones de ATP endógeno prácticamente ...[+]
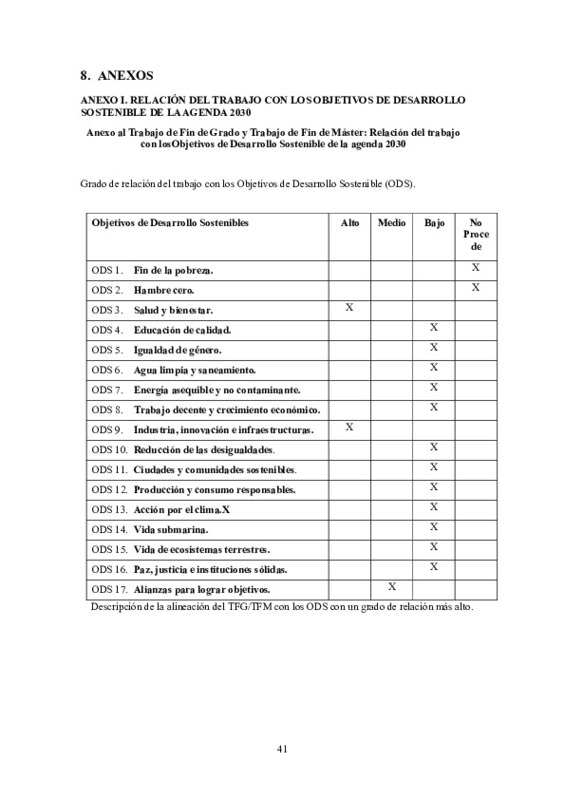
[ES] P2X7 es un receptor inotrópico ligado al canal del calcio implicado en respuestas de daño (trombo-inflamación). Incomprensiblemente, el receptor para ser activado requiere concentraciones de ATP endógeno prácticamente inexistentes en los tejidos; y tras ello abre un poro que permeabiliza la membrana celular inespecíficamente, inusual para los receptores P2X, a numerosas moléculas de alto peso molecular. No obstante, la mayoría de los estudios han sido realizados en células animales y/o transfectadas. En humanos, se ha descrito que es un receptor altamente polimórfico, y a pesar de haberse detectado en células endoteliales (HUVEC), existe mucha controversia respecto a su localización en células inflamatorias y trombóticas. Por ello, el presente trabajo tiene como objetivo detectar la forma nativa del receptor P2X7 en neutrófilos y plaquetas humanas, ya que la isoforma específica del receptor en un entorno celular concreto condiciona su activación, y puede explicar funciones diferentes de las descritas hasta la fecha. El aislamiento de los neutrófilos y plaquetas humanas se realiza a partir de sangre procedente de donantes sanos, y las células HUVEC proceden del cordón umbilical de mujeres tras el parto. Se ha confirmado la expresión basal del receptor P2X7 en neutrófilos y plaquetas humanas mediante Western blot. En neutrófilos, ha sido necesario optimizar el método de extracción de proteína para evitar la degradación del receptor. Los datos han demostrado que mantener los neutrófilos a 4ºC durante el aislamiento, así como utilizar una buena proporción de solución de lisis por número de neutrófilos con alto contenido de inhibidores de proteasas es necesario para obtener un buen rendimiento proteico medido por expresión de GADPH. Adicionalmente, la elección del anticuerpo anti-P2X7 específico es fundamental para una detección precisa. El anticuerpo ab93354 ha permitido detectar el receptor P2X7 en neutrófilos, plaquetas y HUVEC de forma específica y reproducible. Los estímulos pro-inflamatorios y pro-fibróticos a las 4 horas no afectaron la expresión del receptor P2X7 en neutrófilos, plaquetas ni HUVEC, excepto por el ATP en altas concentraciones, que disminuyó la expresión del receptor en neutrófilos humanos asociado a mecanismos de autorregulación celular. Además, se observó mediante RT-PCR que el LPS aumentó la expresión génica del receptor P2X7 e Il-ß1, mientras que el TFG-ß1 disminuyó la expresión de los receptores P2X4 y P2X7 en neutrófilos. Este estudio se destaca por ser uno de los primeros en localizar el receptor P2X7 en neutrófilos y plaquetas humanas mediante Western blot, utilizando un anticuerpo validado comercialmente, y realizando un análisis paralelo en diferentes tejidos humanos. Se han señalado las limitaciones y debilidades de los enfoques previos utilizados para detectar el receptor, proporcionando una base sólida para futuras investigaciones. Por último, la detección del receptor P2X7 en neutrófilos y plaquetas ofrece perspectivas prometedoras para su potencial uso como objetivo terapéutico emergente en enfermedades cardiovasculares e inflamatorias. Estos hallazgos podrían tener implicaciones importantes en el desarrollo de tratamientos más específicos y efectivos para estas condiciones médicas. Adicionalmente, el presente trabajo se alinea con los objetivos de la agenda 2030: ODS 3 y, ODS 9 con un grado de relación alto.
[-]
[EN] P2X7 is an ionotropic receptor linked to the calcium channel involved in damage responses (thrombo-inflammation). Incomprehensibly, to be activated, the receptor requires concentrations of endogenous ATP that are ...[+]
[EN] P2X7 is an ionotropic receptor linked to the calcium channel involved in damage responses (thrombo-inflammation). Incomprehensibly, to be activated, the receptor requires concentrations of endogenous ATP that are practically nonexistent in tissues, after which it opens a pore that nonspecifically permeabilizes the cell membrane, which is unusual for P2X receptors, allowing numerous molecules of high molecular weight to pass through. However, most studies on this receptor have been conducted in animal and/or transfected cells. In humans, it has been described as a highly polymorphic receptor, and despite being detected in endothelial cells (HUVECs), there is much controversy regarding its localization in inflammatory and thrombotic cells. Therefore, the present study aims to detect the native form of the P2X7 receptor in human neutrophils and platelets, since the specific isoform of the receptor in a specific cellular environment condition its activation and it may explain different functions from those described so far. Human neutrophils and platelets are isolated from blood obtained from healthy donors, and HUVECs are derived from the umbilical cord of women after childbirth. The basal expression of the P2X7 receptor in human neutrophils and platelets has been confirmed by Western blot. For neutrophils, it was necessary to optimize the protein extraction method to avoid receptor P2X7 degradation. The data has shown that keeping neutrophils at 4ºC during isolation, as well as using a proper ratio of lysis solution per number of neutrophils with a high content of protease inhibitors, is necessary to achieve good protein yield measured by GADPH expression. Additionally, the choice of a specific anti-P2X7 antibody is crucial for accurate detection. The ab93354 antibody has allowed specific and reproducible detection of the P2X7 receptor in neutrophils, platelets, and HUVECs. Pro-inflammatory and pro-fibrotic stimuli at 4 hours did not affect the expression of the P2X7 receptor in neutrophils, platelets, or HUVECs, except for ATP at high concentrations, which decreased the receptor expression in human neutrophils associated with cellular autoregulation mechanisms. Furthermore, it was observed through RT-PCR that LPS increased the gene expression of the P2X7 receptor and Il-ß1, while TGF-ß1 decreased the expression of the P2X4 and P2X7 receptors in neutrophils. This study stands out for being one of the first to locate the P2X7 receptor in human neutrophils and platelets using Western blot, employing a commercially validated antibody, and conducting a parallel analysis in different human tissues. The limitations and weaknesses of previous approaches used to detect the receptor have been highlighted, providing a solid basis for future research. Finally, the detection of the P2X7 receptor in neutrophils and platelets offers promising perspectives for its potential use as an emerging therapeutic target in cardiovascular and inflammatory diseases. These findings could have significant implications for the development of more specific and effective treatments for these medical conditions. Additionally, this study aligns with the goals of the 2030 agenda: SDG 3 and SDG 9 with a high degree of relevance.
[-]
|