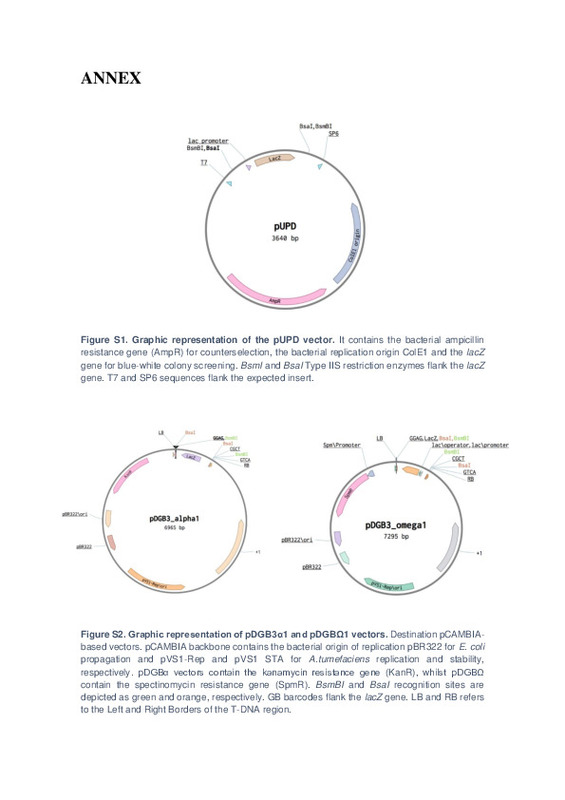
|
Resumen:
|
[ES] La utilización de feromonas de insectos destaca como una alternativa sostenible frente al uso tradicional de pesticidas en el control integral de plagas. Actualmente, las feromonas sexuales están siendo eficientemente ...[+]
[ES] La utilización de feromonas de insectos destaca como una alternativa sostenible frente al uso tradicional de pesticidas en el control integral de plagas. Actualmente, las feromonas sexuales están siendo eficientemente aplicadas en el control de diversas especies de lepidópteros, tales como Helicoverpa armigera o Lobesia botrana, capaces de atacar cultivos de alto valor. Sin embargo, su producción industrial se basa en métodos químicos sumamente costosos, que, usualmente, requieren reactantes peligrosos y generan subproductos perjudiciales para el medio ambiente. Por tanto, se ha propuesto el desarrollo y aplicación de biofactorías como método de producción sostenible de feromonas de insecto.
Hasta el momento, diversas pruebas de concepto han demostrado la potencial utilización de las plantas como biofactorías. En este contexto, los esfuerzos de nuestro grupo de investigación se han centrado en la aplicación de herramientas de la biología sintética para la biosíntesis de feromonas sexuales de polilla en Nicotiana benthamiana. Por otro lado, los hongos filamentosos podrían facilitar la producción optimizada y comercialmente viable de estas feromonas, dado que se utilizan como biofactorías industriales ampliamente estandarizadas, con elevada diversidad metabólica y capacidad de producción de metabolitos secundarios.
El objeto de este trabajo, por tanto, es desarrollar una primera prueba de concepto en la obtención de un hongo filamentoso capaz de expresar las enzimas requeridas en la síntesis de las feromonas sexuales de polilla Z11-16:OH y Z11-16:OAc. Concretamente, se ha generado una ruta genética constituida por una desaturasa (AtrΔ11), una reductasa (HarFAR) y una acetiltransferasa (EaDAcT) mediante el método de clonación Fungal Braid (FB). FB es una nueva rama, específica de hongos, de la tecnología Golden Braid, sistema que permite el ensamblaje modular y estandarizado de los elementos necesarios en la ingeniería genética de plantas y hongos. Mediante la transformación genética mediado por Agrobacterium tumefaciens (ATMT), las construcciones multigénicas resultantes han sido subsecuentemente introducidas en el genoma del hongo Penicillium digitatum. Finalmente, la verificación de los transformantes ha sido llevada a cabo mediante amplificación por PCR. Como resultado, se han seleccionado candidatos Z11-16:OH positivos para el futuro análisis de expresión de la feromona mediante microextracción en fase sólida (HS-SPME) acoplada a cromatografía de gases/masas (GC-MS).
[-]
[EN] Pheromone-based strategies stand out as environmentally benign alternatives to traditional pesticides for insect pest management. Sex pheromones are already been employed for the control of pest lepidopteran species, ...[+]
[EN] Pheromone-based strategies stand out as environmentally benign alternatives to traditional pesticides for insect pest management. Sex pheromones are already been employed for the control of pest lepidopteran species, such as Helicoverpa armigera or Lobesia botrana, that attack high-value crops. However, current approaches for sex pheromones production at an industrial level relies on high-cost chemical methods that often require harmful reactants and generate hazardous waste. Thus, it has been proposed the use of biological factories as a sustainable way to produce insect pheromones.
So far, proof-of-concept studies have proven the feasibility of using plants as biological factories. In this regard, our group efforts have been focused on the application of synthetic biology tools for the production of moth sex pheromones in Nicotiana benthamiana. On the other hand, filamentous fungi could greatly ease pheromone mass production in an optimized and commercially feasible way because they are well-established industrial biofactories with high metabolic diversity and capacity to produce secondary metabolites.
The aim of this project is to generate an initial demonstration of genetic engineered filamentous fungi expressing a set of three enzymes for the production of Z11-16:OH and Z11-16:OAc moth sex pheromones. For this purpose, a designed pathway involving a desaturase (AtrΔ11), a fatty acyl reductase (HarFAR) and an acetyltransferase (EaDAcT) has been assembled using the FungalBraid (FB) cloning methodology. FB is a fungal-specific new branch of the GoldenBraid technology, which allows the modular and standardized assembly of the genetic elements required for genetic engineering of plants and fungi. Resultant multigenic constructs have then been integrated into Penicillium digitatum genome through the Agrobacterium tumefaciens-mediated transformation (ATMT). Finally, transformants verification was accomplished through PCR analysis. As a result, positive candidates for Z11-16:OH production have been selected for future pheromone expression analysis via Headspace Solid Phase Microextraction (HS-SPME) coupled to gas chromatography-mass spectrometer (GC-MS).
[-]
|