|
Resumen:
|
[ES] La placenta es un órgano vital y transitorio que permite el intercambio de oxígeno y nutrientes entre madre y feto durante la gestación. La placentación es un proceso complejo, altamente regulado, esencial para el ...[+]
[ES] La placenta es un órgano vital y transitorio que permite el intercambio de oxígeno y nutrientes entre madre y feto durante la gestación. La placentación es un proceso complejo, altamente regulado, esencial para el desarrollo del mamífero. Depende de la diferenciación de células extraembrionarias hacia linajes trofoblásticos especializados, los principales pilares de la placenta. Defectos en su desarrollo se asocian con complicaciones del embarazo, como diabetes mellitus gestacional (DMG) y preeclampsia; así como con complicaciones fetales, como resistencia a la insulina y restricción del crecimiento fetal (RCF). A pesar de la extensa investigación sobre el desarrollo placentario, los mecanismos moleculares que rigen la placentación son poco comprendidos.
El sustrato del receptor de insulina 2 (IRS2) es una proteína de señalización que desempeña un papel crucial en las vías de señalización de la insulina y factores de crecimiento similares a la insulina (IGFs). Este adaptador citoplásmico se une a receptores tirosina quinasa activos, incluyendo el receptor de insulina (IR) y el receptor de IGF1 (IGF1R). Sin actividad catalítica asociada, IRS2 es capaz de activar la señalización de la fosfatidilinositol 3-quinasa (PI3K/AKT) y la quinasa de proteína Ras activada por mitógenos (MAPK). A pesar de investigación previa sobre las funciones biológicas de IRS2, su participación en el desarrollo placentario sigue sin explorarse.
En este trabajo, dilucidamos la función molecular de Irs2 en células madre trofoblásticas de ratón (mTSCs). Para lograr este objetivo, primero analizamos la dinámica de expresión de IRS2 mediante un experimento de 6 días de diferenciación. Nuestros hallazgos indican que la expresión de IRS2 se modula durante la diferenciación del trofoblasto, lo que sugiere que contribuye al desarrollo placentario.
Para investigar aún más el papel de IRS2 en la regulación de la placentación, caracterizamos las mTSCs KO para Irs2 generadas previamente en el laboratorio con CRISPR/Cas9. Para este propósito, realizamos un análisis de RNAseq y comparamos el transcriptoma en 0, 3 y 6 días de diferenciación de células KO y control. Nuestros resultados muestran que la ausencia de IRS2 afecta la diferenciación trofoblástica tardía.
Con el objetivo de delinear y desglosar las vías de señalización mediadas por IRS2 relacionadas con estos defectos, estimulamos mTSCs con IGFs, factores implicados en el crecimiento placentario. Nuestros datos indican que las mTSCs KO para Irs2 muestran una activación retrasada de la vía PI3K/AKT tras la estimulación con IGF2, resultados similares a los obtenidos tras estimular con IGF1. Esto sugiere que IGF2 e IGF1 tienen roles redundantes, señalando a través de IGF1R para controlar la proliferación y diferenciación trofoblástica. Estos hallazgos proporcionan nuevas ideas sobre las vías de señalización a través de IRS2 en las células madre trofoblásticas de ratón y representan un avance significativo en nuestra comprensión del desarrollo placentario.
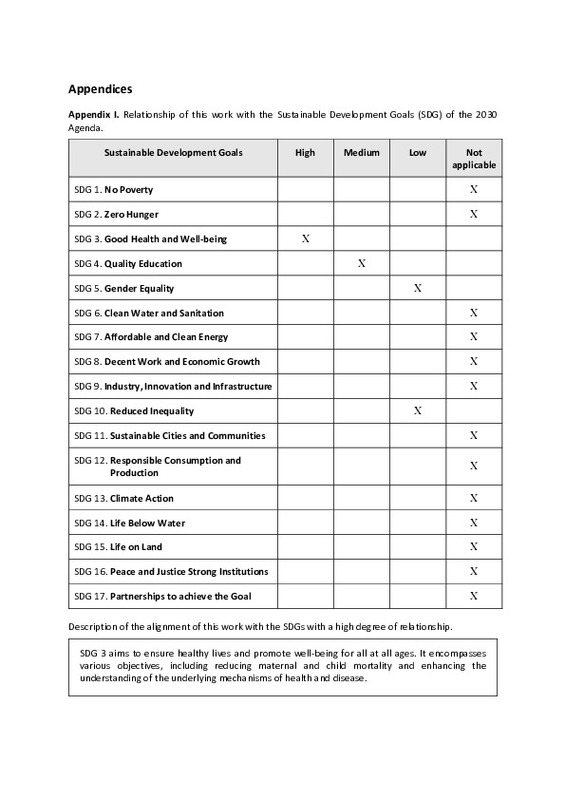
Este trabajo se relaciona mayoritariamente con el Objetivo de Desarrollo Sostenible (ODS) 3 de la Agenda 2030: Salud y Bienestar, aunque también con el 4, 5 y 10 (Anexo I). Contribuye a comprender los mecanismos moleculares que subyacen a las complicaciones durante el embarazo, lo que podría mejorar la salud materna e infantil.
[-]
[EN] The placenta is a transient yet vital organ that allows the exchange of oxygen and nutrients between the mother and the fetus during gestation. Formation of the placenta is a complex and highly regulated process that ...[+]
[EN] The placenta is a transient yet vital organ that allows the exchange of oxygen and nutrients between the mother and the fetus during gestation. Formation of the placenta is a complex and highly regulated process that is essential for mammalian development. It relies on the differentiation of extraembryonic cells into specialized trophoblast lineages that constitute the building blocks of the placenta. Defects in placental development are associated with maternal pregnancy disorders such as gestational diabetes mellitus (GDM) and pre-eclampsia, as well as fetal complications including fetal insulin resistance and fetal growth restriction (FGR). Despite extensive research on placental development, the molecular mechanisms governing placental formation and trophoblast cell lineage differentiation are poorly understood.
Insulin receptor substrate 2 (IRS2) is a signaling protein that plays a crucial role in insulin and insulin-like growth factor (IGF) signaling pathways. This cytoplasmic adaptor protein binds to activated tyrosine kinase receptors, including the insulin receptor (IR) and insulin-like growth factor 1 receptor (IGF1R). Without associated catalytic activity, IRS2 can trigger the activation of the phosphatidylinositol 3-kinase (PI3K/AKT) and mitogen-activated Ras-protein kinase (MAPK) signaling pathways. Despite prior research on the biological functions of IRS2, its involvement in placental development remains unexplored.
In this work, we shed light on the molecular function of Irs2 in mouse trophoblast stem cells (mTSCs). To achieve this objective, we firstly analyzed the dynamics of IRS2 expression by conducting a 6-day time course differentiation experiment. Our findings indicate that IRS2 expression is modulated during trophoblast differentiation, suggesting that it contributes to placental development.
To further investigate the role of IRS2 in regulating placentation, we characterized Irs2 CRISPR/Cas9 KO mTSCs generated previously in the laboratory. For this purpose, we performed RNAseq analysis and compared the transcriptome at 0, 3 and 6 days of trophoblast differentiation of Irs2-null mTSCs to control cells. Our results show that IRS2 depletion affects late trophoblast differentiation events.
With the aim of delineating and dissecting the IRS2-mediated signaling pathways related to these defects, we performed signaling experiments by stimulating starved mTSCs with IGFs, factors implicated in placental growth. Our data indicate that Irs2 KO mTSCs exhibit delayed activation of the PI3K/AKT pathway upon IGF2 stimulation, similarly to the results obtained when stimulating with IGF1. This suggests that IGF2 and IGF1 have overlapping roles, signaling through IGF1R to control trophoblast proliferation and differentiation. These findings provide new insights into the pathways signaling through IRS2 in mTSCs and represent a significant advance in our understanding of placental development.
The following work is related mainly to the Sustainable Development Goal (SDG) 3 within the 2030 Agenda: Good Health and Well-being, but also in some extent to the SDG 4, 5 and 10 (Appendix I). It contributes to understanding the molecular mechanisms underlying pregnancy complications, thereby, potentially improving maternal and child health outcomes.
[-]
|